A tenhle už znáte? Očkovaní lidé prý nešíří infekci :-) Ano, tohle je státní dezinformace, která nadělala a podle všeho ještě nadělá spoustu škody

Je dobré chápat, že orgány které by údajně měly chránit obyvatelstvo, ve skutečnosti jen chabě zakrývají mafiánský podvod na lidech… Ve skutečnosti to vypadá spíše tak, že jsou speciálně vybírány vhodné statistiky a za každou cenu vyráběny materiály pro zdůvodnění vaxxu a pokud někdo dokáže opak, je okázale ignorován v médiích hlavního proudu. No proč asi? Znovu dáváme slovo vysoce odbornému zhodnocení kvality vaxxu od specialistů sdružení SMÍŠ. CITACE:
Vakcína proti covidu nikdy nebyla stoprocentně účinná proti nakažení
Jejím hlavním přínosem měla být ochrana proti závažnému onemocnění a úmrtí. Přesto se zejména v první polovině roku 2021 tradovalo, že očkovaní lidé se nemohou nakazit koronavirem a pokud se v kolektivu vyskytne nákaza, pak jejím zdrojem jsou lidé neočkovaní. Tomuto narativu se věřilo i v druhé půlce roku, kdy však bylo čím dál jasnější, že dochází k tzv. průlomovým infekcím, a postupně se tak zavedla třetí dávka očkování…
Pozitivní PCR test neznamená přítomnost živého viru
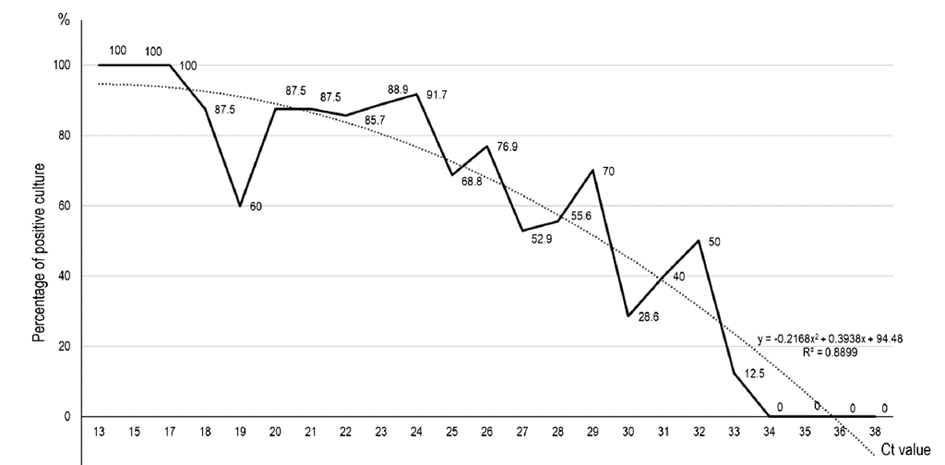
Pozitivita PCR testu na koronavirus není automaticky důkazem, že na sliznici jsou přítomné živé viry schopné nákazy, ale pouze důkazem přítomnosti virové nukleové kyseliny. Přítomnost neviabilního viru zachyceného PCR byla prokázána v mnoha zahraničních studiích, např. [1, 2], nebo i v ČR provedených studiích, např. [3, 4]. Ct je hodnota označující, kolikrát musí dojít ke zdvojnásobení množství virové nukleové kyseliny ve vzorku, aby bylo dosaženo detekovatelného signálu. Čím je hodnota Ct vyšší, tím je virová nálož slabší a je pravděpodobnější, že pacient není infekční.
Nejčastěji se za hranici infekčnosti považuje hodnota Ct 25 [1], nicméně další studie prokázaly na citlivějších buněčných liniích přítomnost infekčního viru v menším procentu případů i nad Ct 30 [3, 5]. Jen pro představu – Ct 30 odpovídá přibližně 10 tisícům kopií virové RNA na 1ml vzorku, skutečně živých virových částic je v něm 1 000x – 10 000x méně než kopií RNA. Tedy při Ct 30 máme 1-10 živých, infikování schopných, virových částic na 1ml vzorku. V laboratoři z tohoto vzorku jsme schopní viry vykultivovat, z hlediska rizika přenosu nákazy na dalšího člověka je to velmi málo. Graf na obr. 1 ze studie La Scoly a kol., ukazuje procento vzorků s viabilním virem při jednotlivých cyklech Ct [5].
Riziko nákazy u očkovaných vs reinfekce u rekonvalescentů
Jedinci, kteří prodělali onemocnění, jsou před reinfekcí chráněni přinejmenším stejně dobře [6], či spíše lépe [7, 8] než vakcinovaní. Graf ze studie Goldberga a kol. níže ukazuje, že i po 6-8 měsících od infekce má osoba, která prodělala COVID-19 (druhý červený sloupec na obr. 2), menší šanci být nakažena znovu než osoba v prvních dvou měsících po dokončení očkování (první šedý sloupec na obr. 2) [8].
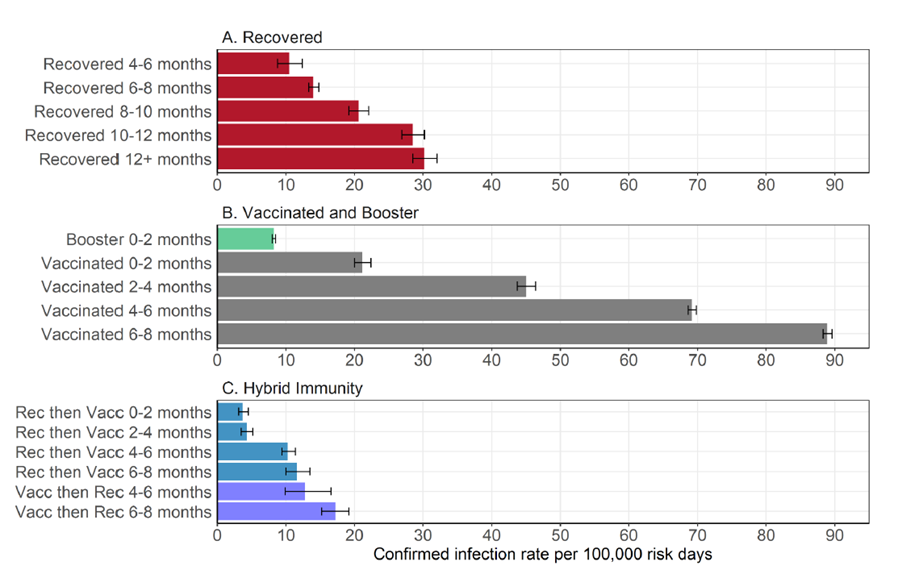
V českém prostředí totéž prokázala studie Berece a kol. z dat ÚZIS [9].
Obr. 3 převzatý z této práce jasně demonstruje, že pravděpodobnost nakažení ve stejném časovém intervalu od imunizačního impulsu (očkování nebo prodělání) je vždy vyšší u vakcinovaného než u rekonvalescenta.
Co více, již po 3-4 měsících od očkování byla pravděpodobnost nakažení očkovaného vyšší než pravděpodobnost nakažení neočkované osoby 13-14 měsíců od nákazy. Podobně můžeme z grafu dovodit, že po 5-10 měsících od infekce je ochrana před PCR pozitivitou stále vyšší než v prvních dvou měsících po očkování.
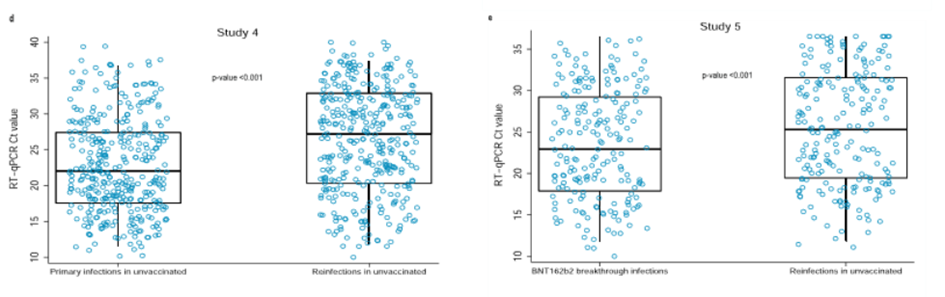
Obr. 4 z práce Abu-Raddada a kol. porovnává Ct cykly (tedy čím vyšší číslo na ose y, tím menší infektivita) vždy ve dvojicích. Levá dvojice srovnává PCR pozitivní pacienty, kteří nebyli dříve očkováni a jsou PCR pozitivní poprvé (levý box) s těmi, kteří také nebyli očkování, ale již dříve byli PCR pozitivní (pravý box). Pravá dvojice pak ukazuje totéž srovnání pro očkované vakcínou Pfizer (levý box) s neočkovanými, kteří již dříve byli PCR pozitivní (pravý box). Každá tečka znamená jednoho pacienta ve studii, středová vodorovná čára uvnitř „boxu“ ukazuje střední hodnotu. Je vidět, že jedinci s pozitivním PCR testem, kteří byli již jednou v minulosti testováni pozitivně (a jak již bylo řečeno, to nutně neznamená, že by dříve, nebo tentokrát, byli nemocní), mají obecně vyšší hodnoty Ct cyklů (jsou méně infekční) než neočkovaní i než očkovaní s průlomovou (první) infekcí [10].
Riziko dalšího přenosu očkovanými osobami v případě PCR pozitivity
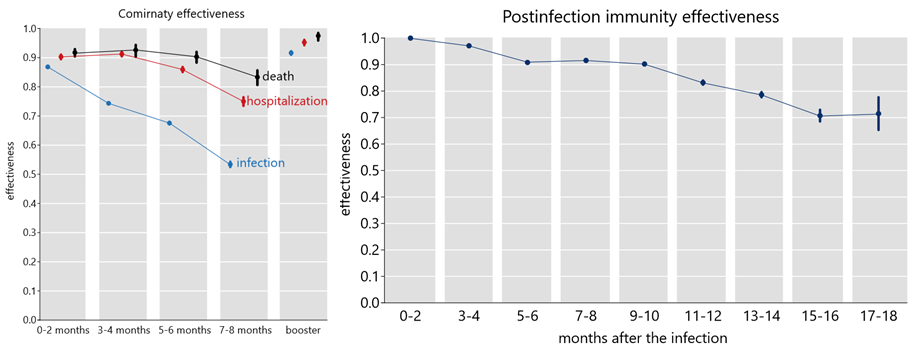
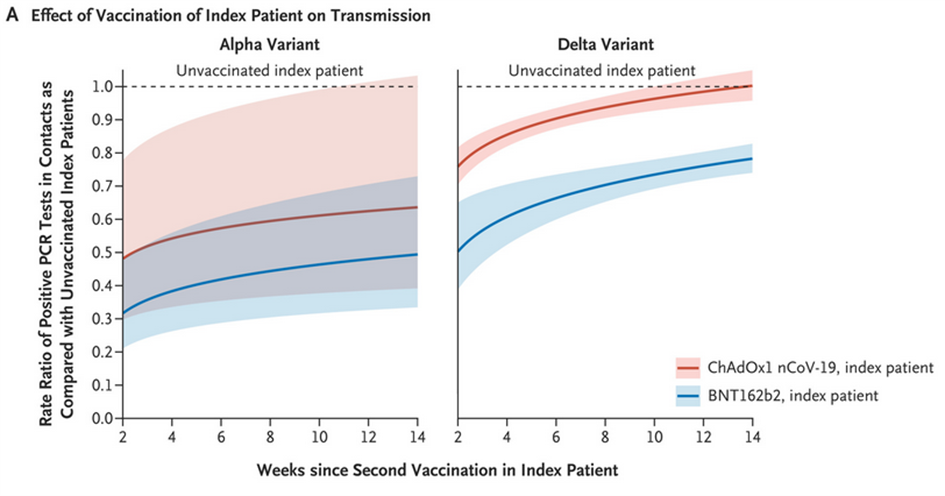
Obr. č. 5 ze studie Dr. Eyreho [11] ukazuje efektivitu vakcín Pfizer a AstraZeneca proti přenosu již nakaženým jedincem (hodnota 1 na ose y znamená nulovou ochranu, hodnota 0 znamená 100% ochranu) v závislosti na počtu týdnů od očkování proti variantám alfa (starší varianta, levý obrázek) a delta (dominující varianta v létě a na podzim 2021, vpravo). Je zřejmé, že vakcína AstraZeneca (červená) po 8 týdnech od očkování již nechrání proti dalšímu přenosu varianty delta prakticky vůbec, zatímco Pfizer (modrá) chrání z pouhých cca 30 procent [11].
Letizia et al. studovali pacienty s reinfekcí a přítomnost viabilního viru na jejich sliznicích zjistili pouze u 25 % pacientů s reinfekcí, a to u skupiny pacientů s průměrným Ct 18, zatímco v druhé skupině reinfikovaných s průměrným Ct 32 nebyl viabilní virus detekován u nikoho [12]. Prodělaná choroba tak (v souladu s imunitními principy a přítomností slizničních IgA protilátek) chrání proti dalšímu přenosu viru pacientem i v případě pozitivního testu lépe (z cca. 75 %) než vakcinace.
Tvorba protilátek
V případě akutní infekce se v těle nakažené osoby po několika dnech od počátku infekce nejprve vytvoří protilátky izotypu IgM [13, 14]. Maximálních hladin IgM dosahuje zpravidla cca 2-4 týdny po počátku klinických příznaků, a poté IgM protilátky klesají (obr.6). Naopak protilátky IgG se objevují později, cca po týdnu až dvou týdnech, a jsou dlouhodobé – přetrvávají po mnoho měsíců až let [15]. IgA protilátky se tvoří podobně jako IgG protilátky a přetrvávají dlouhodobě.
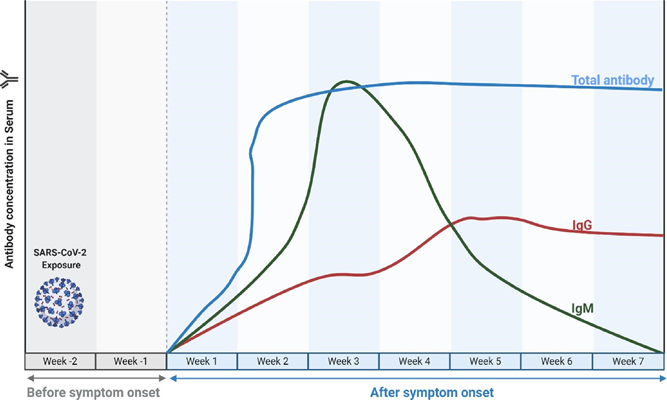
Měření protilátek umožňuje rozlišit nedávnou a starší infekci, čehož se standardně využívá u celé řady infekcí. Jak se uvádí na stránkách amerického Centra pro kontrolu a prevenci nemocí CDC – v případě detekce pozitivního IgM v nepřítomnosti IgG se jedná o akutní infekci (do 7. dne infekce) [15]. Současná detekce IgM a IgG znamená probíhající primoinfekci (po 7. dni), nebo může jít o akutní reinfekci (opakované onemocnění, kdy IgM se tvoří nově a IgG je přítomno z minulé infekce). Kombinace zjištěného pozitivního IgG a negativního IgM typicky odpovídá v minulosti prodělané infekci [15]. K reinfekcím SARS-CoV-2 dochází v současné době častěji než v loňském roce. Studie z léta 2021 (před příchodem mutace omikron) naznačovaly, že u osob s protilátkami proti SARS-CoV-2 je menší pravděpodobnost, že prodělají následnou infekci nebo klinické onemocnění, než u osob bez protilátek [13, 14].
Závěr
Je neomluvitelné, že v zájmu vyššího dobra (tedy jako motivaci lidí k očkování) politici i experti zjednodušili pravdu na tvrzení, že „očkovaní lidé nešíří infekci“. [A jak ukazují data, přesně řečeno, nejedná se o tvrzení založené na pravdě.]
Tímto přístupem byla jednak významně omezena práva neočkovaných osob, ale odehrály se i stovky osobních tragédií jak na pracovištích či ve sportovních a školních kolektivech, tak i v rodinách. Lidé, kteří řídili život ve společnosti a nastavovali tato pravidla, jsou plně zodpovědní za to, co způsobili.
Zdroje
- 1. Bullard, J.; Dust, K.; Funk, D.; Strong, J. E.; Alexander, D.; Garnett, L.; Boodman, C.; Bello, A.; Hedley, A.; Schiffman, Z.; Doan, K.; Bastien, N.; Li, Y.; Van Caeseele, P. G.; Poliquin, G., Predicting infectious SARS-CoV-2 from diagnostic samples. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2020.
- 2. Wölfel, R.; Corman, V. M.; Guggemos, W.; Seilmaier, M.; Zange, S.; Müller, M. A.; Niemeyer, D.; Jones, T. C.; Vollmar, P.; Rothe, C.; Hoelscher, M.; Bleicker, T.; Brünink, S.; Schneider, J.; Ehmann, R.; Zwirglmaier, K.; Drosten, C.; Wendtner, C., Virological assessment of hospitalized patients with COVID-2019. Nature 2020, 581, (7809), 465-469.
- 3. Homza, M.; Zelena, H.; Janosek, J.; Tomaskova, H.; Jezo, E.; Kloudova, A.; Mrazek, J.; Murinova, V.; Madar, R., Performance of Seven SARS-CoV-2 Self-Tests Based on Saliva, Anterior Nasal and Nasopharyngeal Swabs Corrected for Infectiousness in Real-Life Conditions: A Cross-Sectional Test Accuracy Study. Diagnostics 2021, 11, (9), 1567.
- 4. Homza, M.; Zelena, H.; Janosek, J.; Tomaskova, H.; Jezo, E.; Kloudova, A.; Mrazek, J.; Svagera, Z.; Prymula, R., Five Antigen Tests for SARS-CoV-2: Virus Viability Matters. Viruses 2021, 13, (4), 684.
- 5. La Scola, B.; Le Bideau, M.; Andreani, J.; Hoang, V. T.; Grimaldier, C.; Colson, P.; Gautret, P.; Raoult, D., Viral RNA load as determined by cell culture as a management tool for discharge of SARS-CoV-2 patients from infectious disease wards. European journal of clinical microbiology & infectious diseases : official publication of the European Society of Clinical Microbiology 2020, 39, (6), 1059-1061.
- 6. Mao, Y.; Wang, W.; Ma, J.; Wu, S.; Sun, F., Reinfection rates among patients previously infected by SARS-CoV-2: systematic review and meta-analysis. Chinese Medical Journal 2022, 135, (2), 145-152.
- 7. Rahman, M. M.; Masum, M. H. U.; Wajed, S.; Talukder, A., A comprehensive review on COVID-19 vaccines: development, effectiveness, adverse effects, distribution and challenges. Virusdisease 2022, 1-22.
- 8. Goldberg, Y.; Mandel, M.; Bar-On, Y. M.; Bodenheimer, O.; Freedman, L.; Ash, N.; Alroy-Preis, S.; Huppert, A.; Milo, R., Protection and waning of natural and hybrid COVID-19 immunity. medRxiv 2021, 2021.12.04.21267114.
- 9. Berec, L.; Smid, M.; Pribylova, L.; Majek, O.; Pavlik, T.; Jarkovsky, J.; Zajicek, M.; Weiner, J.; Barusova, T.; Trnka, J., Real-life protection provided by vaccination, booster doses and previous infection against covid-19 infection, hospitalisation or death over time in the Czech Republic: a whole country retrospective view. medRxiv 2021, 2021.12.10.21267590.
- 10. Abu-Raddad, L. J.; Chemaitelly, H.; Ayoub, H. H.; Tang, P.; Coyle, P.; Hasan, M. R.; Yassine, H. M.; Benslimane, F. M.; Al-Khatib, H. A.; Al-Kanaani, Z.; Al-Kuwari, E.; Jeremijenko, A.; Kaleeckal, A. H.; Latif, A. N.; Shaik, R. M.; Abdul-Rahim, H. F.; Nasrallah, G. K.; Al-Kuwari, M. G.; Butt, A. A.; Al-Romaihi, H. E.; Al-Khal, A.; Al-Thani, M. H.; Bertollini, R., Relative infectiousness of SARS-CoV-2 vaccine breakthrough infections, reinfections, and primary infections. Nat Commun 2022, 13, (1), 532.
- 11. Eyre, D. W.; Taylor, D.; Purver, M.; Chapman, D.; Fowler, T.; Pouwels, K. B.; Walker, A. S.; Peto, T. E. A., Effect of Covid-19 Vaccination on Transmission of Alpha and Delta Variants. New England Journal of Medicine 2022, 386, (8), 744-756.
- 12. Letizia, A. G.; Smith, D. R.; Ge, Y.; Ramos, I.; Sealfon, R. S. G.; Goforth, C.; Gonzalez-Reiche, A. S.; Vangeti, S.; Weir, D. L.; Alshammary, H.; Chen, H. W.; George, M.-C.; Soares-Schanoski, A.; Lizewski, R. A.; Lizewski, S. E.; Marayag, J.; Miller, C. M.; Nunez, E.; Porter, C. K.; Ana, E. S.; Schilling, M.; Sugiharto, V. A.; Sun, P.; Termini, M.; van de Guchte, A.; Troyanskaya, O. G.; van Bakel, H.; Sealfon, S. C., Viable virus shedding during SARS-CoV-2 reinfection. The Lancet Respiratory Medicine 2021, 9, (7), e56-e57.
- 13. Zhou, W.; Xu, X.; Chang, Z.; Wang, H.; Zhong, X.; Tong, X.; Liu, T.; Li, Y., The dynamic changes of serum IgM and IgG against SARS-CoV-2 in patients with COVID-19. Journal of medical virology 2021, 93, (2), 924-933.
- 14. Emeribe, A. U.; Abdullahi, I. N.; Shuwa, H. A.; Uzairue, L.; Musa, S.; Anka, A. U.; Adekola, H. A.; Bello, Z. M.; Rogo, L. D.; Aliyu, D.; Haruna, S.; Usman, Y.; Muhammad, H. Y.; Gwarzo, A. M.; Nwofe, J. O.; Chiwar, H. M.; Okwume, C. C.; Animasaun, O. S.; Fasogbon, S. A.; Olayemi, L.; Ogar, C.; Emeribe, C. H.; Ghamba, P. E.; Awoniyi, L. O.; Musa, B. O. P., Humoral immunological kinetics of severe acute respiratory syndrome coronavirus 2 infection and diagnostic performance of serological assays for coronavirus disease 2019: an analysis of global reports. International Health 2021, 14, (1), 18-52.
- 15. Center for Disease Control and Prevention Interim Guidelines for COVID-19 Antibody Testing. https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html#ref-11 (2022/04/14)